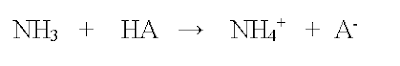
ΔH anger förändringarna i entalpin, alltså om reaktionen avger energi (exoterm reaktion) eller upptar energi (endoterm reaktion). Detta resonemang gäller samtliga reaktioner, inte bara upplösningar i vatten.
För upplösningar i vatten kan entalpiförändringen uppskattas genom att stoppa ner en termometer i kärlet med vatten, innan man häller i salt. Först måste man se till att både vatten och salt har samma temperatur (lämpligen rumstemperatur). Vattnet måste alltså få termostatera sig först, annars vet man ju inte vad man mäter!
Om man ska räkna på entalpiförändringarna måste man göra antagandet att all energi som avges från reaktionen upptas av vattnet. Ju mer salt som hälls i gör det svårare att räkna med vattnets specifika värmekapacitet, 4.18 J/(mol K). Här ska vi bara kvalitativt se på saken, alltså inte räkna utan bara se om energi avges eller upptas. Då är mängd salt (eller mängd vatten) inte viktig.

Försök 1: NaCl

Med natriumklorid sänks temperaturen i glaset något. Reaktionen är alltså endoterm eftersom det går åt energi för att lösa saltet.
Försök 2: Na2CO3
Med natriumkarbonat är det helt annorlunda. Här skjuter temperaturen i höjden, se bild till höger. Stora mängder energi avges.
Försök 3: NaHCO3
Med natriumbikarbonat är situationen likartad som för NaCl.
Försök 4: NaNO3
Med natriumnitrat sänks temperaturen ett stort antal grader. Alltså åtgår energi för att lösa saltet. Reaktionen är endoterm.
Försök 5: NaOH
Med natriumhydroxid är situationen verkligen den motsatta. Nu avges mängder med energi; temperaturen skjuter i höjden, så var försiktig (också för att detta salt är frätande!).

Försök 6: NaC6H5COO
Natriumbensoat påverkar knappt temperaturen så här är det svårt att avgöra om upplösningsreaktionen är endoterm eller exoterm.
Försök 7: (NH4)2CO3
Med ammoniumkarbonat sänks temperaturen mycket, alltså endoterm reaktion. De två karbonatsalterna uppför sig alltså verkligen tvärtom! Se bild till vänster!
Varför exoterm/endoterm?
När ett salt ska lösas upp krävs att jonbidningarna som håller samman anjoner (-) och katjoner (+) i saltets kristaller bryts. Det kräver energi. Hur mycket beror på hur starka dessa bindningar är. Samtidigt frigörs energi när vattenmolekylerna kan närma sig (hydratisera) de upplösta jonerna. Hur mycket beror på vilka joner det handlar om.
Om upplösningen av ett salt totalt sett frigör energi (exoterm reaktion, höjd temperatur) eller upptar energi (endoterm reaktion, sänkt temperatur) beror alltså på nettoresultatet av ovanstående energiförändringar. Vissa upplösningar är endoterma och andra är, som vi sett, exoterma.
Vad avgör om ett salt är lösligt eller inte?
Det som avgör om en reaktion eller inte kan ske är om den s.k. fria energin minskar. Den kanske viktigaste kemiska ekvationen är följande:
ΔG=ΔH-TΔS
Här betecknar ΔG ändringen i den fria energin medan T är temperaturen (i Kelvin) och ΔS är ändringen i s.k. entropi, enkelt uttryckt hur graden av oordning ändras (är oordningen stor är entropin stor och tvärtom).
För att en reaktion (t.ex. en upplösning) ska kunna ske i nämnvärd utsträckning måste ΔG vara negativ. Är ΔG positiv går reaktionen istället åt andra hållet.
För upplösningsreaktioner är ΔS alltid positiv eftersom oordningen ökar när saltets joner plötsligt kan röra sig fritt i vattnet istället för att sitta bundet i saltets kristallstruktur. Den högra termen i ekvationen ovan är alltså alltid positiv vilket bidrar till att ΔG blir negativ och upplösningsreaktionen möjlig.
ΔH, däremot, varierar beroende på salt. Är bindningarna mellan jonerna i saltets kristaller tillräckligt starka blir reaktionen mycket starkt endoterm. Den kan vara så pass endoterm att ökningen i entropi (oordning) inte kan väga upp. I så fall blir saltet olösligt. Många olösliga salter är de med polyvalenta joner, alltså joner med två-, tre- eller fyrvärda joner, t.ex. kalciumkarbonat (CaCO3), bariumsulfat (BaSO4) och många sulfider (med S²¯-jonen). Hos dessa salter är bindningarna mellan jonerna i det fasta saltet mycket starka vilket kräver mycket energi. ΔH blir starkt positivt, så pass positivt att även ΔG blir positivt. Saltet blir mycket svårlösligt.
ΔG avgör alltså om ett salt är lösligt eller inte.
ΔH avgör om energi frigörs eller upptas.
ΔH, ΔS och temperaturen bestämmer ΔG.