
Använd skyddsglasögon!
Exempel 1: Ättiksyra vs acetat
Tillsätt någon tesked 24% ättiksyra till rent vatten. Notera doften av ättika. Tillsätt också några droppar av rödkålsindikatorn. Lösningen blir nu röd. Tillsätt nu en bas (natriumkarbonat, natriumbikarbonat eller natriumhydroxid) till dess att färgen ändras till lila. Notera hur lukten i stort sett försvunnit! Observera att natriumhydroxid är starkt frätande - använd skyddsglasögon och skyddshandskar!
Vad hände?
Med natriumhydroxid sker följande reaktion:

Med natriumkarbonat sker istället följande reaktion (karbonatjonen, en ganska stark bas plockar vätejoner från ättiksyran, bildar kortlivad kolsyra H2CO3 som delas upp i vatten H2O och koldioxid CO2).

Även natriumvätekarbonat (bikarbonat) är en tillräckligt stark bas för att plocka vätejoner från ättiksyran (även i detta fall bildas kolsyra som omedelbart delas upp i vatten och koldioxid):

I samtliga fall har ättiksyran (CH3COOH) deprotonerats till acetat (CH3COO‾). Det är endast den protonerade formen, ättiksyra, som har en tydlig doft, detta eftersom den protonerade, oladdade formen, är betydligt flyktigare, medan de laddade jonerna har avsevärt svårare att lämna lösningen (jämför att smaka på kondenserat vatten på locket nästa gång du kokar pasta i saltat vatten).
Genom att sätta till en luktfri syra, citronsyra, citronsaft eller äppeljuice, kommer acetaten att återgå till den protonerade formen ättiksyra – då återkommer också lukten av ättika. Prova!
Exempel 2: Ammoniak vs ammonium.
Tillsätt några droppar 8% hushållsammoniak till ett glas med vatten. Notera försiktigt lukten av lösningen. Tillsätt några droppar rödkålsindikator. Lösningen blir grön.
Lös upp lite citronsyra i lite vatten i ett annat glas.
Tillsätt nu droppvis citronsyralösningen till ammoniaklösningen ända tills ammoniaklösningen inte längre är grön. Notera att lösningen nu luktar avsevärt mindre.
Vad har hänt?
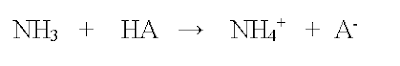
Här betecknar HA en generell syra. Denna kommer att protonera basen ammoniak som blir den protonerade, laddade ammoniumjonen. Denna är inte flyktig såsom ammoniakmolekylen. Därför luktar lösningen mycket mindre nu.
Återfå luktande ammoniak genom att tillsätta natriumkarbonat (eller natriumhydroxid, obs frätande!). Då kommer basen (karbonatjonen eller hydroxidjonen) att plocka vätet (deprononera) ammoniumjonen och ammoniaken återuppstår.
Experiment 3
Detta experiment har du säkerligen redan gjort. Notera lukten av ett stycke fisk. Häll över lite citronsaft och lukten försvinner.
Vad hände?
Fisk innehåller trimetylamin som fungerar precis som ammoniak i exempel 2. Aminen protoneras av citronsaft och blir då inte längre flyktig. Reaktionen är denna:

Det fungerar alltså lika bra med äppeljuice eller apelsinjuice som med citronsaft.
Men luktar inte salterna lite ändå?
Jo, helt luktfria blir salterna ändå inte. Detta beror på att följande jämvikter inställer sig för acetat- och ammoniumsalterna (egentligen för alla salter även om det för anjoner av starka syror som saltsyra är försumbart lite).


Även om endast en mycket liten del av acetat- och ammoniumjonerna reagerar med vatten och bildar ättiksyra och ammoniak är det ändå tillräckligt för att man ändå ska kunna känna en viss doft. Ett snarlikt exempel är hjorthornssalt (ammoniumkarbonat (NH4)2CO3) som säljs som ett pulver för bakning. Detta salt luktar svagt av - ja just det - ammoniak. (När saltet används till bakning delas det fullständigt upp i ammoniak, koldioxid och vattenånga som ger fluffighet åt kakan).
No comments:
Post a Comment